Статья
Митохондриальная дисфункция
Митохондриальная дисфункция рассматривается как универсальный патологический процесс, не привязанный к конкретной нозологической форме или причине, ключевым проявлением которого является нарушение энергетической функции митохондрий. В зависимости от происхождения данное состояние подразделяют на первичную митохондриальную патологию, связанную с генетическими и наследственными факторами, и вторичную, развивающуюся под влиянием внешних воздействий — приобретённых заболеваний, интоксикаций, лекарственной нагрузки или других неблагоприятных факторов окружающей среды.
Поскольку именно митохондрии обеспечивают основную часть клеточного энергообмена, митохондриальные нарушения в первую очередь затрагивают ткани с высоким уровнем энергопотребления. Чаще всего в патологический процесс вовлекаются центральная нервная система, скелетные мышцы и сердечная мышца, однако при прогрессировании дисфункции поражение может развиваться практически в любой ткани организма.
Клинические проявления митохондриальной дисфункции носят неспецифический характер и во многом определяются локализацией митохондрий с нарушенной функцией. Именно поэтому симптомы могут значительно варьировать — от неврологических и мышечных расстройств до кардиальных и системных проявлений, что нередко осложняет своевременную диагностику данного состояния.
Содержание
- Структура и функции митохондрий
- Механизмы возникновения митохондриальных повреждений
- Основные симптомы и клинические проявления
- Диагностика митохондриальных заболеваний
- Методы лечения и профилактики
- Частые вопросы
Индивидуальный подход к сохранению здоровья и энергии
В контексте митохондриальной дисфункции всё чаще говорят о комплексных стратегиях сохранения энергии, профилактики старения и оптимизации обменных реакций в организме. Современные программы персонального оздоровления, такие как «Код молодости» от Mriya Life, направлены на глубокую диагностику состояния организма и метаболизма, снижение хронического воспаления и улучшение работы митохондрий — клеточных «электростанций», которые влияют на выработку энергии и устойчивость к стрессу.
Эта стратегия основана на многокомпонентном подходе, включающем анализ биологического возраста, оценку метаболизма и качества сна, коррекцию питания, индивидуально подобранные тренировки и терапевтические методы для восстановления энергетических реакций на уровне клеток. Программа помогает не только поддерживать здоровье, но и снижать риски развития возраст-зависимых состояний, включая сердечно-сосудистые и метаболические проблемы, связанные с митохондриальной недостаточностью.
Структура и функции митохондрий
Количество митохондрий в клетке определяется её энергетическими потребностями. В соматических клетках человека их число варьирует от 200 до 2000, тогда как в половых клетках оно строго регламентировано: сперматозоиды содержат около 16 митохондрий, а ооциты — до 100 000. Наибольшая концентрация митохондрий характерна для метаболически активных тканей — скелетной и сердечной мускулатуры, печени и головного мозга. Исключение составляют зрелые эритроциты, не содержащие митохондрий.
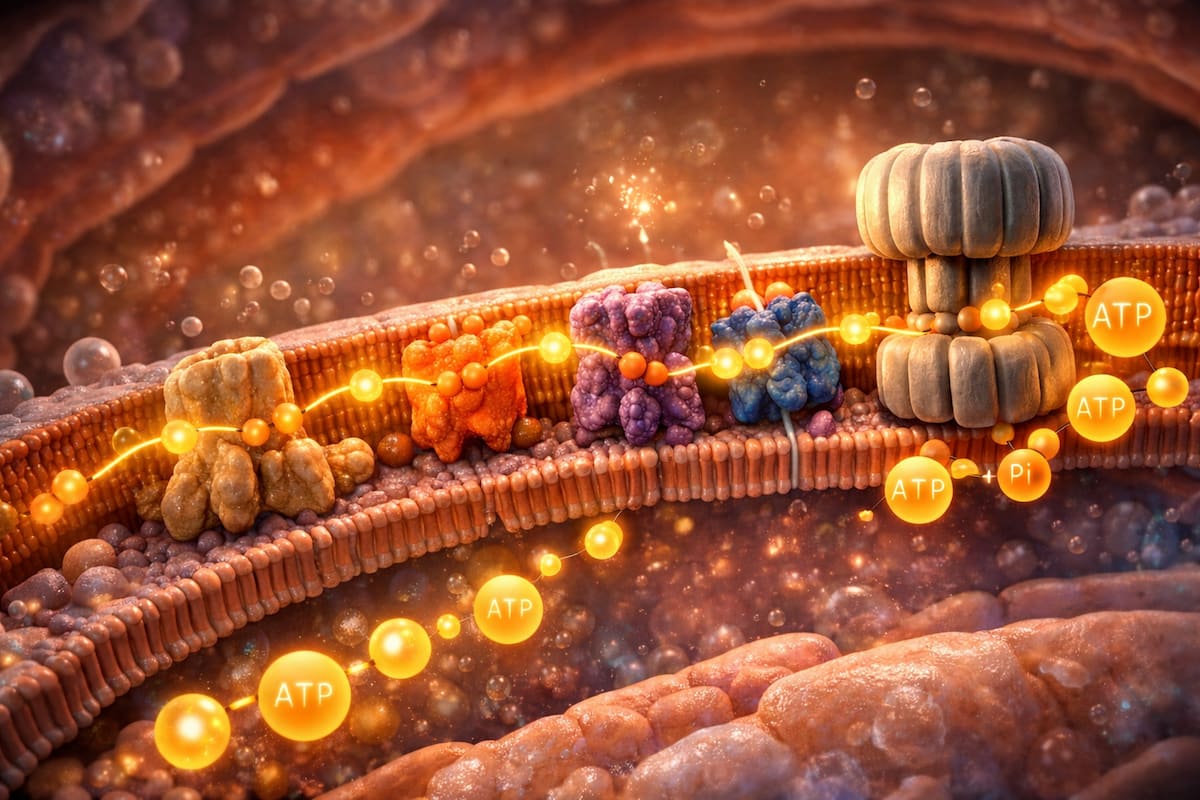
Митохондрии обеспечивают более 90 % клеточной энергии за счёт окислительного фосфорилирования, которое реализуется при взаимодействии цикла трикарбоновых кислот (цикла Кребса) и цепи переноса электронов (ЦПЭ). В ходе цикла Кребса углеводы и жиры метаболизируются с образованием восстановленных коферментов НАДН и ФАДН₂, необходимых для синтеза АТФ.
Ключевым этапом энергетического обмена является превращение пирувата, образующегося при гликолизе, в ацетил-КоА с участием пируватдегидрогеназного комплекса. Работа этого мультиферментного комплекса зависит от наличия коферментов и витаминов группы B (B1, B2, B3, B5), а также липоевой кислоты. При низком уровне АТФ пируват направляется в цикл Кребса, а при избытке энергии — в процессы глюконеогенеза. Ацетил-КоА может также образовываться при окислении жирных кислот, транспорт которых в митохондрии осуществляется с участием L-карнитина.
Восстановленные коферменты НАДН и ФАДН₂ передают электроны в цепь переноса электронов, расположенную во внутренней мембране митохондрий и включающую пять ферментных комплексов (I–V). С участием коэнзима Q10 и цитохрома C формируется протонный градиент, используемый АТФ-синтазой для образования АТФ. Для полноценной работы этих процессов необходимо достаточное поступление витаминов, микроэлементов и кофакторов, нарушение которых приводит к снижению энергетического обмена и развитию митохондриальной дисфункции.
Механизмы возникновения митохондриальных повреждений
Основным механизмом повреждения митохондрий является избыточное образование реактивных форм кислорода (РФК), преимущественно в комплексах I и III цепи переноса электронов. В процессе окислительного фосфорилирования митохондрии используют большую часть клеточного кислорода, при этом до 4 % его может превращаться в супероксидные радикалы. В норме РФК нейтрализуются антиоксидантными ферментами, однако при перегрузке этих систем развивается оксидативный стресс.
Супероксид и его производные повреждают ключевые структуры митохондрий — липиды мембран, белки, ферменты дыхательной цепи и митохондриальную ДНК. Дополнительное повреждающее действие оказывают оксид азота (NO) и образующийся при его взаимодействии с активными формами кислорода пероксинитрит, обладающий выраженной цитотоксичностью. В результате нарушается активность митохондриальных ферментов и снижается синтез АТФ, что запускает порочный круг митохондриальной дисфункции.
Наиболее чувствительным к оксидативному повреждению является комплекс I, нарушение функции которого связано с гибелью нейронов и развитием нейродегенеративных заболеваний, включая болезнь Паркинсона и наследственную оптическую нейропатию Лебера. Усиление образования РФК также наблюдается при гипергликемии и хроническом воспалении, что способствует развитию сердечно-сосудистых и метаболических осложнений.
Важную роль в возникновении митохондриальных повреждений играют нарушения нутритивного баланса. Дефицит витаминов и микроэлементов, необходимых для работы ферментов цикла Кребса и цепи переноса электронов, усиливает оксидативный стресс и повреждение митохондрий. Наиболее распространённым примером является дефицит железа, который снижает активность дыхательной цепи и способствует прогрессированию митохондриальной дисфункции.
Основные симптомы и клинические проявления
Митохондриальные расстройства характеризуются полиморфной клинической картиной, отражающей нарушение клеточного энергетического обмена. Наиболее частыми симптомами являются мышечная слабость, повышенная утомляемость, непереносимость физической нагрузки, судорожные состояния и птоз. В связи с высокой энергетической потребностью особенно часто страдают мышцы, головной мозг и сердечная мышца, что определяет ведущие клинические проявления заболевания.
При прогрессировании митохондриальной дисфункции возможно развитие миопатий и нейродегенеративных состояний, включая атаксию, нарушения зрения и когнитивные расстройства. Диагностика таких нарушений основывается на лабораторных и инструментальных методах, среди которых ключевую роль играют генетическое тестирование и нейровизуализация, позволяющие выявить митохондриальные мутации и оценить степень поражения тканей.
Диагностика митохондриальных заболеваний: методы и подходы
Диагностика митохондриальных заболеваний представляет собой многоэтапный и междисциплинарный процесс, требующий участия врачей различных специальностей. Это связано с клинической вариабельностью митохондриальной патологии и отсутствием строго специфичных симптомов, что обуславливает необходимость комплексного подхода к обследованию пациента.
Ключевое значение в подтверждении диагноза имеет молекулярно-генетическое исследование, направленное на выявление мутаций в митохондриальной ДНК и ядерных генах, кодирующих митохондриальные белки. У большинства пациентов с клиническими признаками митохондриальных заболеваний обнаруживаются точечные мутации или делеции мтДНК, что подтверждает генетическую природу данных расстройств.
Важным диагностическим этапом являются биохимические анализы, включающие оценку активности ферментов дыхательной цепи, а также определение уровней лактата и пирувата в крови и спинномозговой жидкости. Повышение концентрации лактата рассматривается как маркёр нарушений окислительного фосфорилирования и энергетического обмена.
Дополнительную информацию предоставляют морфологические и инструментальные методы исследования. Биопсия мышечной ткани позволяет выявить структурные изменения митохондрий, включая характерные «рваные красные волокна» при синдроме MERRF. Инструментальная диагностика — МРТ, МР-спектроскопия, ЭКГ, ЭХО-КГ и ЭЭГ — применяется для оценки функционального состояния нервной, сердечно-сосудистой и других систем организма.
Своевременная и точная диагностика митохондриальных заболеваний имеет принципиальное значение, поскольку комплексная интерпретация генетических, биохимических и инструментальных данных позволяет определить оптимальную тактику ведения пациента и оценить прогноз течения заболевания.
Методы лечения и профилактики
Лечение митохондриальных заболеваний на сегодняшний день носит преимущественно симптоматический и метаболически направленный характер. Основная цель терапии — улучшение энергетического обмена, снижение выраженности клинических проявлений и замедление прогрессирования заболевания. В связи с многофакторным патогенезом митохондриальной дисфункции лечение, как правило, требует комплексного и индивидуализированного подхода, включающего фармакотерапию, нутритивную поддержку и коррекцию образа жизни.
Одним из наиболее изученных средств является коэнзим Q10 (убихинон) — ключевой участник цепи переноса электронов митохондрий, обладающий выраженными антиоксидантными свойствами. Его применение способствует повышению синтеза АТФ, стабилизации мембран и снижению уровня лактата. Коэнзим Q10 используется при дефиците убихинона и ряде митохондриальных синдромов, включая MELAS и MERRF, а также при ишемической болезни сердца. В клинической практике он может применяться в широком диапазоне доз, однако эффект часто носит поддерживающий характер.
L-карнитин играет важную роль в транспорте жирных кислот в митохондрии и обеспечении энергетического метаболизма. Его применение особенно эффективно при первичном и вторичном дефиците карнитина, а также при митохондриальных заболеваниях, сопровождающихся снижением окисления жирных кислот. Использование L-карнитина способствует улучшению общего состояния и энергетического баланса у пациентов.
Для поддержки энергетического обмена также применяются креатин, янтарная кислота (сукцинат) и дихлорацетат. Креатин может улучшать мышечную функцию и снижать утомляемость, однако данные о его клинической эффективности остаются неоднозначными. Дихлорацетат активирует пируватдегидрогеназу и снижает уровень лактата, но его длительное применение ограничено риском развития периферической нейропатии. Сукцинат используется при нарушениях тканевого дыхания, хотя его роль в хронической терапии остаётся предметом дискуссий.
Дополнительную роль играют витамины и аминокислоты, включая фолиевую кислоту, L-аргинин, витамины группы B, витамины C и E, липоевую кислоту и глутатион. Эти вещества участвуют в работе митохондриальных ферментов и антиоксидантной защите, однако доказательная база их эффективности при митохондриальных заболеваниях пока ограничена. Перспективными направлениями остаются исследования препаратов, направленных на стимуляцию митохондриального биогенеза и снижение оксидативного стресса.
В рамках профилактики и поддерживающей терапии важное значение имеет диетотерапия, включая низкоуглеводные и высокожировые диеты, способствующие оптимизации энергетического обмена. Регулярное медицинское наблюдение и динамическая коррекция схемы лечения позволяют своевременно оценивать эффективность терапии и адаптировать её к индивидуальным особенностям пациента.
Значение ранней диагностики и комплексного подхода
Раннее выявление митохондриальных заболеваний играет ключевую роль в выборе эффективной тактики лечения и снижении риска тяжёлых осложнений. Появление симптомов со стороны нервной или сердечно-сосудистой системы в молодом возрасте должно рассматриваться как основание для углублённого обследования, включая молекулярно-генетическое тестирование.
Особое значение ранняя диагностика имеет для пациентов с отягощённым семейным анамнезом, поскольку своевременное выявление митохондриальных мутаций позволяет не только подтвердить диагноз, но и оценить потенциальные риски для родственников. Полученные данные служат основой для разработки индивидуального плана ведения пациента, направленного на замедление прогрессирования заболевания, профилактику осложнений и улучшение качества жизни.
Подведем итог
Митохондриальная дисфункция представляет собой сложный и многоуровневый патологический процесс, в основе которого лежат нарушения функционирования митохондрий — ключевых клеточных органелл, отвечающих за выработку энергии, регуляцию метаболизма и процессы апоптоза. В настоящее время установлено, что митохондриальные дефекты лежат в основе многих заболеваний, включая нейродегенеративные, сердечно-сосудистые, эндокринные и воспалительные состояния, а также участвуют в механизмах старения организма.
Из-за высокой энергетической потребности тканей особенно часто страдают мозг, мышцы и сердце, что объясняет появление таких симптомов, как мышечная слабость, боли, судороги, мигрени, хроническая усталость, энцефалопатия, кардиомиопатия и офтальмоплегия. Установлено, что митохондриальная недостаточность может быть связана с сахарным диабетом, включая диабет 2 типа, нарушениями регуляции глюкозы и состояниями, обусловленными хроническим воспалением и оксидативным стрессом.
Ранняя диагностика с помощью молекулярно-генетических, биохимических и инструментальных методов даёт возможность своевременно выявить митохондриальные дефекты и разработать индивидуальную стратегию лечения. Комплексный подход, включающий медикаментозную терапию, коррекцию питания, использование антиоксидантов и поддержку защитных механизмов клетки, позволяет замедлить прогрессирование заболевания и повысить качество жизни пациентов. Современная медицина рассматривает митохондриальные нарушения как важную междисциплинарную проблему, находящуюся в фокусе научной, клинической и профилактической медицины.
FAQ — часто задаваемые вопросы
Митохондриальная дисфункция — это состояние, при котором митохондрии теряют способность эффективно производить энергию. Из-за этого страдают органы и ткани с высоким энергопотреблением, а в организме возникает энергетическая недостаточность.
Да. Установлено, что митохондриальные нарушения участвуют в развитии сахарного диабета, инсулинорезистентности и осложнений, связанных с поражением сосудов, нервной системы и других органов.
Наиболее распространённые проявления — мышечная слабость, быстрая утомляемость, судороги, боли, мигрени, когнитивные нарушения, а также признаки со стороны сердца и нервной системы. У детей могут наблюдаться задержка развития и симптомы, относящиеся к педиатрии.
В первую очередь страдают головной мозг, сердце и мышцы, однако при прогрессирующем течении могут вовлекаться практически все органы и системы организма.
Полное излечение в большинстве случаев пока невозможно, однако комплексная терапия позволяет контролировать симптомы, улучшать энергетический обмен и замедлять прогрессирование болезни.